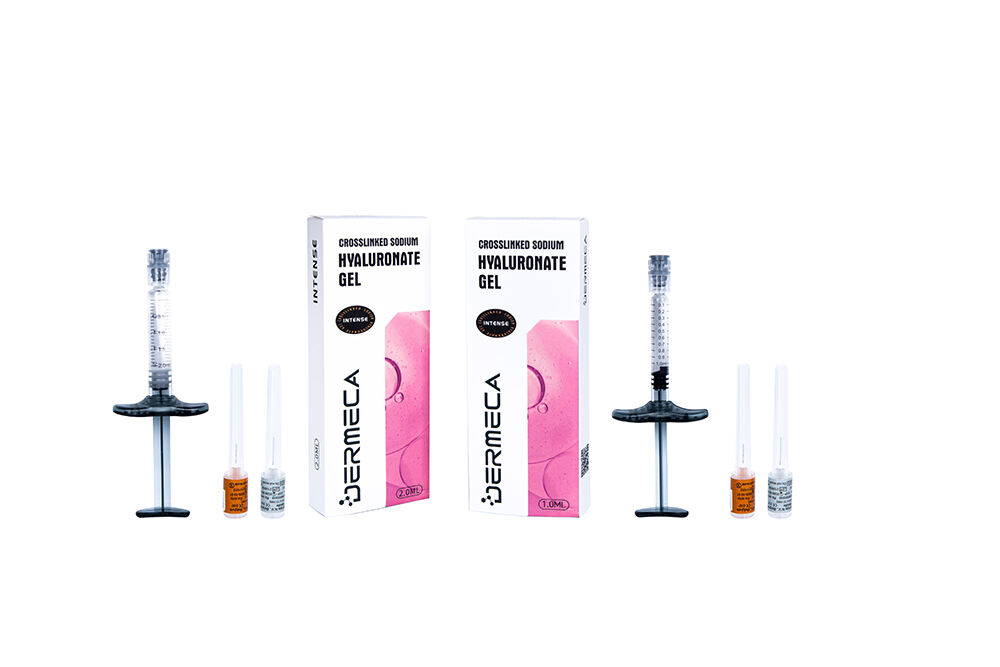
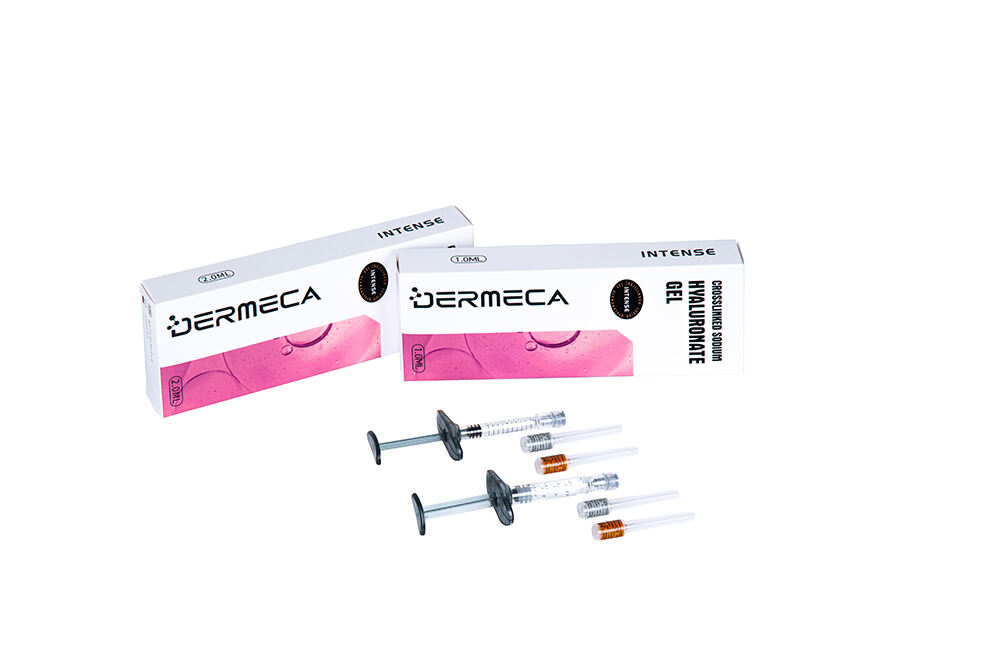
Dermeca INTENSE Biphasisches Hyaluronsäure-Dermal-Filler mit Lidocain
Name: Dermeca INTENSIV
Attribut: Verquertes Hyaluronsäure-Füllstoff mit Lidocain
Nadelgröße: 27Gx1Stk +26Gx1Stk
HA-Konzentration: 24mg / ml
Partikelgröße : 0,28-0,5mm
- Überblick
Dermeca INTENSE wird für mittleres und tiefes Dermis verwendet, um sowohl superfizielle als auch tiefe Gesichtslinien zu füllen.
DERMECA Crosslinkendes Natriumhyaluronatgel für die Plastische Chirurgie ist ein steriles, biologisch abbaubares, viskoelastisches, isotonisches, homogenisiertes und durchsichtiges injizierbares Gel-Implantat. Es handelt sich um eine stabilisierte Form von Natriumhyaluronat (HA) nicht-tierischen Ursprungs, ausschließlich für den Einmalgebrauch bestimmt. Diese Art von crosslinkender Hyaluronsäure bietet im Vergleich zur natürlich vorkommenden HA eine verlängerte Halbwertszeit, da letztere einen physiologischen Abbau im Unterhautgewebe erfährt. DERMECA LIGHT eignet sich für flache Falten um Augen und Mund, MEDIUM ist geeignet für Lippenvergrößerung und mittlere Auffüllung, INTENSE wird bei tieferen Linien und Wangenaufbau angewandt.
| Name | Dermeca INTENSIV |
| Eigenschaft | Verquertes Hyaluronsäure-Füllstoff mit Lidocain |
| Nadelgröße | 27Gx1Stk +26Gx1Stk |
| HA-Konzentration | 24mg / ml |
| lidocainhydrochlorid | 3mg / ml |
| Partikelgröße | 0,28-0,5mm |
| Einfügetiefe | mittlerer und tiefer Dermis |
| Wirkdauer | 6-10 Monate |
| Lagerbedingungen | Bei 2-30°C aufbewahren. Nicht einfrieren. Vor Licht schützen. |
| Anwendungsbezeichnungen | Es wird zur Füllung von oberflächlichen bis tiefen Linien verwendet, wie Sorgenfalten, Krähenfüße, Stirnfalten, unteren Augenlidern und Schläfenhöhlen. |
Gegendarstellungen
•Patienten mit einer Vorgeschichte von hypertrophischen oder Keloiddarstellungen oder mit einer aktuellen Streptokokkeninfektion, aktueller Hautkrankheit, Entzündung oder anderen Infektionen. Patienten mit einer Vorgeschichte von Autoimmunerkrankungen oder die immuntherapeutische Behandlung erhalten.
•Patienten, die bekanntermaßen allergisch gegen Hyaluronsäure sind.
•Dieses Produkt wurde nicht an schwangeren oder stillenden Frauen sowie nicht an Kindern getestet. Es gibt daher keine Hinweise auf die Sicherheit in diesen Gruppen.
•Die vorhandenen klinischen Daten haben die Sicherheit und Wirksamkeit dieses Produkts für den Einsatz bei Erwachsenen bestätigt. Es sind keine klinischen Daten für die Verwendung des Produkts bei Personen unter 18 Jahren verfügbar. Daher wird das Produkt für diese Gruppe nicht empfohlen.
•Antikoagulierte Patienten oder Patienten, die Plättchenaggregationshemmer (z. B. ASS) einnehmen, sollten ihren Arzt konsultieren.
•Das Produkt sollte außerhalb der Reichweite von Kindern aufbewahrt werden.
•Nicht bei Patienten mit Blutungsstörungen verwenden.
•Nicht bei Patienten verwenden, die Thrombolytika oder Antikoagulanzien einnehmen oder innerhalb der letzten 2 Wochen Plättchenaggregationshemmer genommen haben.
•Nicht bei Patienten mit hyperplastischer Narbe und Streptokokkeninfektion verwenden.
•Verwenden Sie das Produkt nicht zusammen mit Laserbehandlung, chemischem Peeling, intensivem Pulslicht oder Dermabrasionsbehandlung.
• Das Produkt sollte nicht an oder in der Nähe von anatomischen Stellen verwendet werden, an denen eine aktive Hauterkrankung, Entzündung, Infektion oder verwandte Zustände vorliegen.
•Pflanzen Sie keine Bereiche, in denen Injektionen anderer Produkte durchgeführt wurden, erneut.
Erwartete unerwünschte Ereignisse
Häufig und kurzzeitige, selbstlimitierende Reaktionen nach der Injektion umfassen Erythema, Schwellung, Schmerz, Juckreiz und Verfärbung.
Dieses Produkt gewinnt den normalen Druck der Gewebe. Da der Druck der Gewebe manchmal erhöht (im Fall von Ödemen) oder verringert (im Fall von Austrocknung) ist, kann sich das Erscheinungsbild unter diesen Umständen leicht ändern. In schwerwiegenderen Fällen kann eine kurze Kursmethyleprednisonhilfreich sein. Patienten mit dieser Art von Reaktion dürfen nicht erneut mit diesem Produkt behandelt werden.
Komplikation
Die geschätzte Häufigkeit dieser Komplikation beträgt 0,05 % (1 von 2000 Patienten), was sie als seltene Ereignisse einstuft. Es wurden keine schwerwiegenden unerwünschten Ereignisse gemeldet.