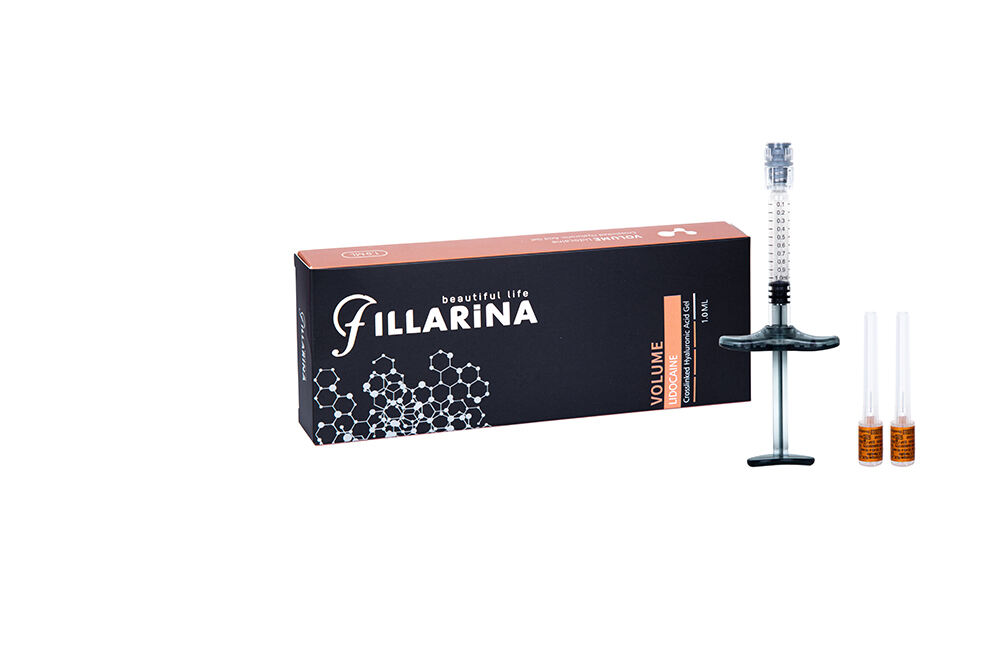
Fillarina VOLUME Jedno fazowy kwas hyaluronowy Wypełniacz dermalny z Lidokainą
Imię i nazwisko: FILLARINA VOLUME
Atrybut: Wpisywalny wypełniacz kwasu hialuronowego fazowego z lidokainą
Stężenie HA: 24mg / ml
Bufor fosforowy pH 7.2 : w ilości odpowiedniej (q.s.)
Lidokain: 3mg/ml
- Przegląd
Napełniacze dermalne Fillarina VOLUME są wykorzystywane do korekcji drobnych linii i zmarszczek lub defektów twarzy.
FILLARINA od Tiera Biotechnology to nowa linia 3 monofazowych wypełniaczy kwasu hyaluronowego stosowanych do poprawy mikrominiaturyzacji skóry, korekty płytkich do głębokich zmarszczek, zwiększenia objętości, konturu obszarów twarzy oraz zaciskania porów. FILLARINA to monofazowy wypełniacz kwasu hyaluronowego zawierający lidokainę, który łączy mniejsze rozmiary cząsteczek z długotrwałą efektywnością. Każdy wypełniacz składa się z wysokiej koncentracji kwasu hyaluronowego i naturalnych substancji używanych do dostarczania skórze niezbędnych składników odżywczych, objętości i wilgotności skóry.
| Imię i nazwisko | FILLARINA VOLUME |
| Atrybut | Wpisywalny wypełniacz kwasu hialuronowego fazowego z lidokainą |
| Stężenie HA | 24mg / ml |
| Bufor fosforowy pH 7.2 | q.s. |
| Lidocainą | 3mg/ml |
| Warunki Przechowywania | Przechowywać przy temperaturze od 2 °C do 25 °C, nie zamarzać. |
| Wskazania dotyczące stosowania | Gel implantacyjny FlLLARlNA przeznaczony jest do wstrzykiwania w średnie i głębokie warstwy dermy w celu korekty średnich i/lub głębokich depresji skóry, a także do definiowania i wzmocnienia warg. |
Wskazania zakazujące
•FlLLARINA jest przeciwwskazana dla pacjentów z ciężkimi alergiami manifestującymi się historią anafilaksji lub historią lub obecnością wielu ciężkich alergii.
•FlLLARINA zawiera ślady białek bakteryjnych gram-dodatnich i jest przeciwwskazana dla pacjentów z historią alergii na ten materiał.
•FlLLARlNA zawiera ślady lidokainy i jest przeciwwskazana dla pacjentów z historią alergii na ten materiał.
Środki ostrożności
•FILLARINA jest opakowywana do użytku jednopacjentowego. Nie resterylizować. Nie używać, jeśli opakowanie jest otwarte lub uszkodzone. FILLARINA jest wskazywana wyłącznie do iniekcji podskórrodermowych i iniekcji w błonę śluzową warg. Na podstawie badań przedklinicznych, dawkowanie u pacjentów powinno być ograniczone do 20 mL FILLARINY na 60 kg (130 funtów) masy ciała w ciągu roku. Bezpieczeństwo iniekcji większych ilości nie zostało ustalone. Bezpieczeństwo i skuteczność leczenia innych rejonów anatomicznych niż zmarszczki i bruzdy twarzy (np. wargi) nie zostało potwierdzone w kontrolowanych badaniach klinicznych. Podobnie jak we wszystkich procedurach przezskórrodermowych, implantacja wypełniacza dermalnego niesie w sobie ryzyko zakażenia. Należy przestrzegać standardowych środków ostrożności związanych z materiałami do iniekcji. * FILLARINA ma być stosowana zgodnie z dostarczoną formą. Modyfikacja lub użycie produktu poza Instrukcją Do Użycia może negatywnie wpłynąć na sterylność, homogeniczność i wydajność produktu, dlatego nie można go już zagwarantować.
•Bezpieczeństwo użytkowania podczas ciąży, w okresie karmienia piersią lub u pacjentów poniżej 18 roku życia nie zostało ustalone.
•Bezpieczność u pacjentów znanego podatnych na tworzenie się blizn keloidalnych, blizn gruczolowych i zaburzeńpigmentacji nie została badana.
•FILLARINA powinna być stosowana z ostrożnością u pacjentów poddawanych terapii immunosupresyjnej.
•Pacjenci, którzy używają substancji mogących przedłużać krwawienie (takich jak aspiryna, leki przeciwwrzodne i warfaryna), mogą, podobnie jak przy każdej iniekcji, doświadczyć zwiększonego sinienia lub krwawienia w miejscach iniekcji.
• Po użyciu, szkielety dostrzykowe i igły mogą stanowić potencjalne biozagrożenia. Obsługuje i usuwaj te elementy zgodnie z zaakceptowanymi praktykami medycznymi oraz obowiązującymi lokalnymi, państwowymi i federalnymi wymaganiami.
•Gel dostrzykowy FILLARINA jest przejrzystym, bezbarwnym gelem bez cząsteczek. W przypadku gdy zawartość szkieletu pokazuje znaki rozdziału i/lub wygląda na mętny, nie używaj szkieletu; powiadom wsparcie produkcyjne Sinclean pod numerem +86-519-85855985.
•jeśli seans lasera, chemiczne obieranie skóry lub jakakolwiek inna procedura oparta na aktywnym reagowaniu dermy jest rozpatrywana po leczeniu FILLARINĄ, istnieje możliwe ryzyko wywołania reakcji zapalnej w miejscu wskazań. Reakcja zapalna jest również możliwa, jeśli produkt został podany przed tym, jak skóra całkowicie się zagoiła po takiej procedurze.
•Niedostosowanie się do instrukcji dotyczących montażu igły może prowadzić do odłączenia igły oraz/lub wycieku produktu w połączeniu między luerlockiem a kołem igły. Jeśli igła jest zablokowana, nie zwiększaj ciśnienia na tłok, ale przerwij wstrzykiwanie i wymień igłę. Sportowcy powinni zostać poinformowani, że ten produkt zawiera zasadę czynną, która może dać pozytywny wynik w teście antydopingowym. Pracownicy medyczni muszą uwzględnić fakt, że ten produkt zawiera lidokainę. Skład tego produktu jest zgodny z polami stosowanymi w badaniach rezonansu magnetycznego.
EFEKTY UBoczne
•Pacjenci muszą zostać poinformowani, że związane z wszczepieniem tego produktu występują potencjalne działania niepożądane, które mogą pojawić się natychmiast lub z opóźnieniem. Obejmują one, lecz nie ograniczają się do: Reakcji zapalnych (zaczerwienienie, obrzęk, rumień itp., które mogą być związane z swędzeniem lub bólem przy ucisku albo jednym i drugim, występującym po zastrzyku. Te reakcje mogą trwać przez tydzień. Krwiaki. Ugniatanie lub guzki w miejscu iniekcji. Zabarwienie lub przebarwienie miejsca iniekcji.
•Słaby efekt lub słabe działanie wypełniające.
•Zgłoszono przypadki zgonów tkankowych w obszarze glabelli, abstesusów, granulomu oraz natychmiastowej lub opóźnionej hipersensywności po zastrzykach kwasu hialuronowego. Dlatego zaleca się uwzględnienie tych potencjalnych ryzyk.
•Pacjenci powinni zgłosić reakcje zapalne trwające dłużej niż tydzień lub każdy inny rozwijający się efekt uboczny swojemu lekarzowi jak najszybciej. Lekarz powinien zastosować odpowiednie leczenie.
•Wszelkie inne niepożądane działania towarzyszące podaniu FILARINY należy zgłosić dystrybutorowi i/lub producentowi.