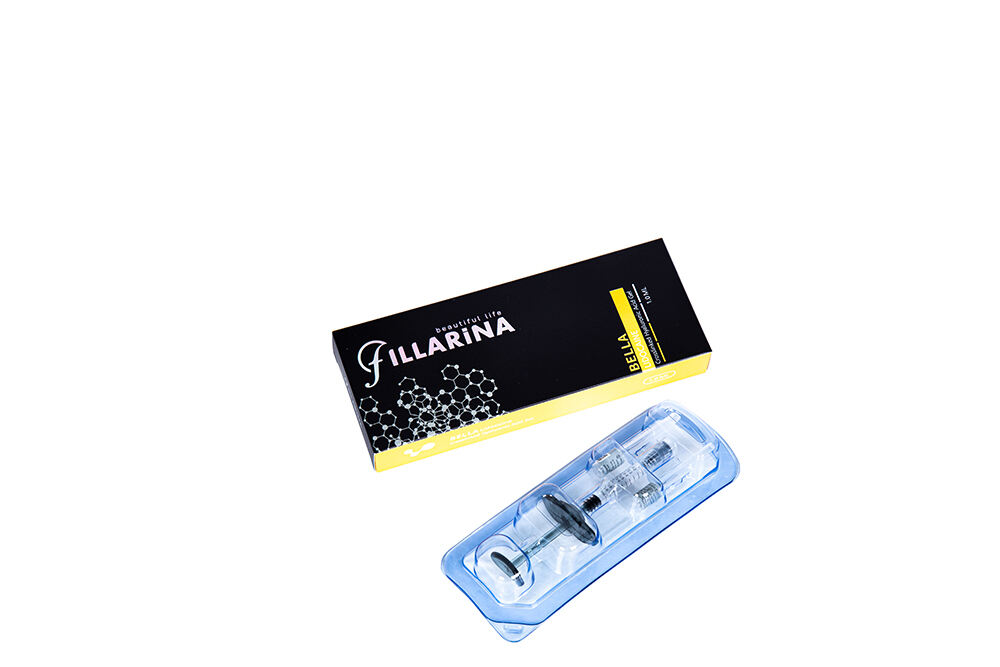
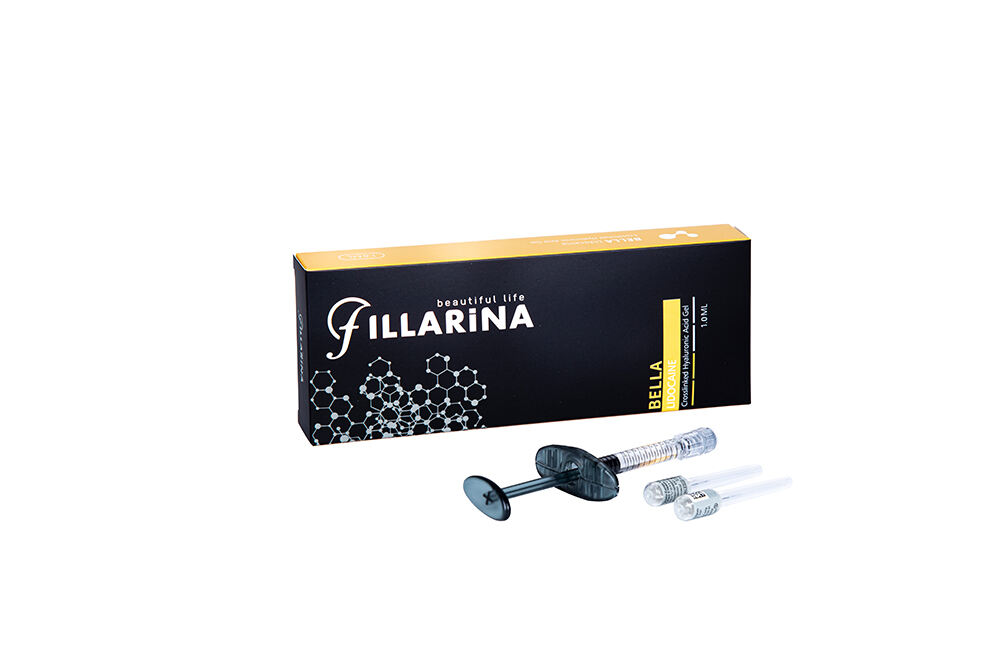
Fillarina BELLA Egyágú Hialuronasztartalmú Dermalis Töltő Lidokainnal
Név: FILLARINA BELLA
Attribútum: Kapcsolódó monofázisú hyaluronas injekciós töltő anyag lidokainnal
HA koncentráció: 20mg / ml
Foszfát búfer pH 7.2 : mérn. egys.
Lidokain: 3mg/ml
- Áttekintés
A Fillarina BELLA dermi töltők finom vonalak és röhögések vagy arcfoltok korrigálására szolgálnak.
A FILLARINA a Tiera Biotechnology új, 3 monofázisos hialuronsav-töltőanyagból álló terméksorozata, amelyet a bőr miniaturizálódásának javítására, felszíni és mély ráncok kijavítására, térfogat növelésére, az arcrészletek kontúrozására és a pórusok szűkítésére használnak. A FILLARINA egy lidokaint is tartalmazó monofázisos hialuronsav alapú töltőanyag, amely kis méretű részecskéket kombinál hosszan tartó hatékonysággal. Minden készítmény nagy koncentrációjú hialuronsavat és természetes anyagokat tartalmaz, amelyek a bőr számára szükséges tápanyagokat, térfogatot és hidratáltságot biztosítanak.
| Név | FILLARINA BELLA |
| Attribútum | Kapcsolódó monofázisú hyaluronas injekciós töltő anyag lidokainnal |
| HA koncentráció | 20mg / ml |
| Foszfát búfer pH 7.2 | q.s. |
| Lidokain | 3mg/ml |
| Tárolási Feltételek | Tárolja 2 °C-től 25 °C-ig, ne zárja be. |
| Használatra vonatkozó utalások | A FlLLARlNA befogadható gélliszt indikált a közép és mély dermiszbe történő befúrásra a bőr közép és/ vagy mély déréseinek javítására, valamint az ajkak kontúrhozárására és növelésére. |
Ellenjavak
•A FlLLARINA ellentétben van azokkal a betegekkel, akiknél súlyos allergiák vannak, amelyek anafalaxis történetével vagy több súlyos allergia történetével vagy jelenlétével járnak.
•A FlLLARINA nagyon kis mennyiségű gram-pozitív baktérium-proteint tartalmaz, és ellentétben van azokkal a betegekkel, akik korábban ilyen anyagra allergiás reakciót mutattak.
•A FlLLARlNA nagyon kis mennyiségű lidokain-t tartalmaz, és ellentétben van azokkal a betegekkel, akik korábban ilyen anyagra allergiás reakciót mutattak.
Használati óvintézkedések
•A FILLARINA egyetlen beteg számára csomagolva van. Ne sterilizálja újra. Ne használja, ha a csomag nyitott vagy sérült. A FILLARINA kizárólag intradermális injekciókra és ajka közrefogató rétegének befúródására vonatkozik. A preklinikai tanulmányok alapján a pacienseken nem túl 20 mL FILLARINA szabad 60 kg (130 lbs) testtömegenként évente. A nagyobb mennyiségű befúrás biztonsága nem állapította meg. A biztonság és hatékonyság más anatomiailag meghatározott területeken való kezelésre, mint az arcsi röhögések és gödrök (pl. ajak) nem volt bebizonyítva kontrollált klinikai tanulmányokban. Ahogy minden transkután eljárás esetén, a dermisztikus töltőanyag implantáció fertőzés kockázatot tartalmaz. Az injekciós anyagokhoz kapcsolódó szabványos óvatosságokat kell követni. A FILLARINA szerinti felhasználáshoz szánt. A termék módosítása vagy a Használati Utasításokon kívül történő használata sértettebbé teheti a termék sterilítését, homogenitását és teljesítményét, így már nem bízható rá.
•A bázis biztonsága a terhesség alatt, a dohányzó nők között vagy a 18 évnél fiatalabb betegek esetében nem állapított meg.
•A keloid-formálódásra, hypertrofikus cicatriszre és pigmentációs zavarokra vonatkozóan ismert kiszolgáltathatóságú betegek esetében a biztonság nem vizsgálta.
•A FILLARINA-t óvatosan kell használni az immunossupressziós terápia alatt álló betegeknél.
•Azok a betegségek, akik olyan anyagokat használnak, amelyek hosszabbíthatják a vércikkeli (például aspirin, nem szteroides inflammatorius gyógyszerek és warfarin), bár bármilyen injekcióval, növekedett foltosodást vagy vércikkeltési helyet tapasztalhatnak az injekciós helyeken.
• Az alkalmazás után a kezelési szintet és a rúdokat potenciális biológiai veszélyek lehetnek. Kezelje és dobjon el ezeket az elemeket a fogadott orvosi gyakorlat és a helyi, állami és szövetségi követelmények szerint.
•A FILLARINA injekciós gélfélék egy világos, szín nélküli gélfélék, anélkül, hogy részecskék lennének. Annak esetén, ha a szintet tartalma elválasztás jeleit mutatja és/vagy felhősnek tűnik, ne használja a szintet; értesítse a Sinclean Termék Támogatását a +86-519-85855985 számon.
•ha laserkezelést, kémiai levágást vagy bármilyen más, aktív bőrreagációján alapuló eljárást terveznek a FILLARINA kezelés után, akkor van lehetőség arra, hogy inflammatóri reakció kezdődjön az indicium helyén. Inflammatóri reakció is lehetséges, ha a terméket a bőr teljes gyógyulása előtt alkalmazzák ilyen eljárás után.
•A szúrág rögzítésére vonatkozó utasítások nem megfelelő betartása szúrág kiszabadulására és/vagy termék felfutásra vezethet a luer-lock és szúrág fejszoros csatlakozásánál. Ha a szúrág blokkolódik, ne növelje a nyomást a tolótörzsre, hanem állítsa le az injekciót és cserélje ki a szúrágot. A sportolóknak rá kell világítani, hogy ez a termék aktív anyagot tartalmaz, amely pozitív eredményt eredményezhet a dopingtesztben. A orvosi munkatársak figyelembe kell venniük, hogy ez a termék lidokain tartalmaz. A termék összetétele kompatibilis az MRI (mágneses rezonancia) képalkotásra használt mezőkkel.
MELLÉKHATÁSOK
•A betegeket tájékoztatni kell arról, hogy a termék beültetéséhez kapcsolódóan ezek az ártalmak azonnal jelentkezhetnek, vagy később jelentkezhetnek. Ezek közé tartoznak, de nem kizárólag: Gyulladásos reakciók (vörösség, duzzanat, erythema stb.), melyekhez viszketés vagy nyomási fájdalom, illetve mindkettő társulhat az injekció beadását követően. Ezek a reakciók akár egy héig is eltarthatnak. Vérzések. A befecskendezés helyén megkeményedés vagy csomók keletkezhetnek. A befecskendezés helyén foltok keletkezhetnek vagy elszíneződés alakulhat ki.
•Rossz hatás vagy gyenge töltési hatás.
•A glabellaris régióban fellépő nécrozis esetei, abscesszek, granulomák és az állatoromsav-injekciók után jelentkező rögtönös vagy késői allergiai reakciókat jelentették meg, ezért ajánlott ezekkel a potenciális kockázatokkal számolni.
•A betegek olyan gyulladási reakciókról, amelyek egy hónapnál tovább tartanak, vagy bármilyen más fejlődő mellékhatásról lehető leggyorsabban tájékoztatniuk kell orvost. Az orvos megfelelő kezelést kell alkalmaznia.
•A FILLARINA injektálásával kapcsolatban bármilyen más kívánatlan mellékhatást a forgalmazónak és/vagy a gyártónak be kell jelenteni.