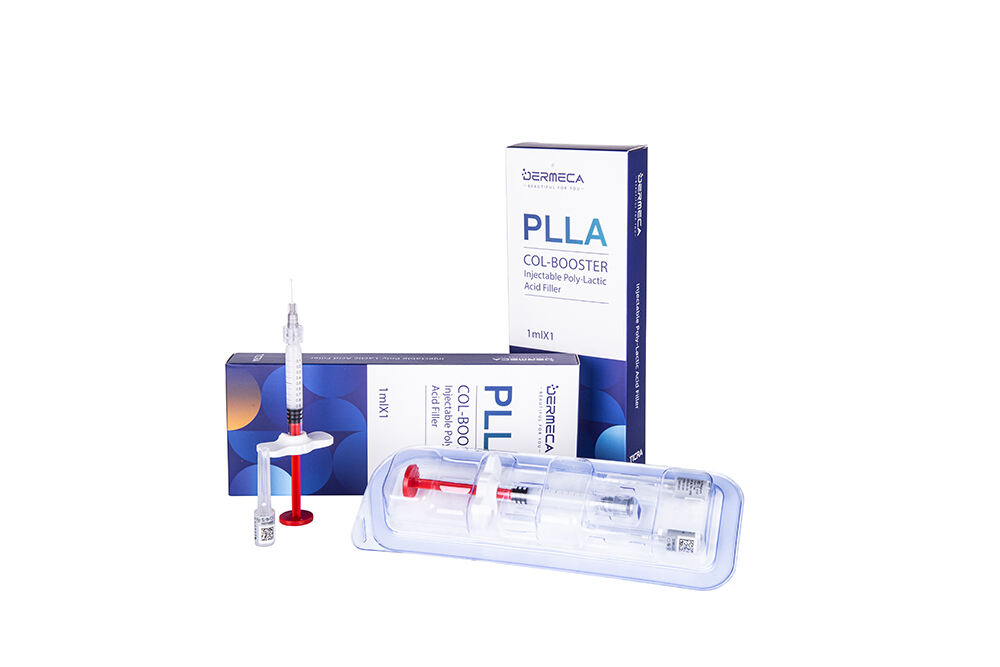
Dermeca Plla Fylder 1 ml, Kollagenstimulator
Navn: Dermeca Lido Injectable Plla Fylder
Attribut: Injectable ansigtsimplantat
PLLA-b-PEG mikrosfærer : 150mg/ml
HA-koncentration: 17mg/ml
Lidocaine : 0,3mg/ml
- Oversigt
Dermeca Plla Filler, en formulering af korslinket hyaluronsyre-natriumgel infunderet med PLLA-mikrosfærer, er omhyggeligt udviklet til målrettede injektioner i områder, der ønsker volumetrisk forbedring og løfteeffekter. Det er ideelt til ansigtzoner såsom tidsområderne, buebenene, næsestrukturen, columella nasi, hageområdet, nesens basis og de dybe malarområder og giver en subtil og opfriskende løftning. Behandlingen er konstrueret til at levere et resultat, der både virker naturligt og genopretter ungdomsfulde konturer.
Dermeca Plla Filler består af en forudfyldt sprøjte, et steril hypodermisk nål til enkeltbrug og gellet, der er forudfyldt i sprøjten. Gellen er hovedsagelig sammenfattet af krydset sodium hyaluronat, poly-l-lactic syre (PLLA) mikrosfærer (mærket indhold: 18 %), lidocain hydrochlorid og fosfatbuffersystemet. De nominelle koncentrationer af sodium hyaluronat (forberedt ved mikrobiel fermentation) og lidocain hydrochlorid er henholdsvis 17 mg/mL og 3 mg/mL. Sprøjten med forudfyldt gel er steriliseret ved autoclavning, og det sterile hypodermiske nål til enkeltbrug er steriliseret ved epoxydioxid eller stråling. Filleren er til enkeltbrug (hyllevirksomhed: 2 år).
Fyldemidlet er en melkete hvid, tyk gel med krydset sodium hyaluronat og PLLA-mikrokugler som de vigtigste komponenter. Den mediane partikelstørrelse af PLLA-mikrokuglerne er 32 μm ± 6 μm, hvor mere end 95 % af mikrokuglerne har en størrelse på 20–45 μm. Gellen er et dermal vævfyldningsmiddel, der indsprøjtes i de dybe lag af denermis samt subkutante overflade- og dyblag for at korrigere nasolabiale folder, og PLLA-mikrokuglerne i gellen kan forlænge fyldningsvarigheden. Wrinkle Severity Rating Scale (WSRS)-scoren viser, at flest patienter stadig har en forbedring på mere end 1 point efter 12 måneder.
| Navn | Dermeca Lido Injectable Plla Fylder |
| Attribut | Injectable ansigtsimplantat |
| HA koncentration | 17mg/ml |
| PLLA-b-PEG mikrokugle | 150mg/ml |
| Lidocaine | 0.3mg/ml |
| Version | Lidocaine |
| Injektionszone | Ansigt |
| Varighed af effekt | Op til 2 år |
| Oplagringstilstand | Gem ved 2°C–25°C, og frys ikke |
| Anvendelsesbetingelser | Gellen bruges til indsprøjtning i de dybe lag af denermis og subkutante overflade- og dyblag for at korrigere moderate til alvorlige nasolabiale folder. |
Kontraindikationer
•Tidligere eller aktive autoimmune sygdomme, under behandling med immunsuppressive eller immunmodulerende midler, aktiv hudinfektion.
•Herpes.
•Allergi over for hyaluronsyre, poly-l-laktinsyre, mælkesyre, polyethylenglykol eller lidokain (lokalanæstetikum).
•Forhøjet blødningstendens; behandlet med trombolytika, antikoagulantia eller hæmmere af blodpladeaggregation inden for de to uger forud for injektion.
•Gravid/ammande kvinder og mindreårige.
•Keloid/hypertrof arveudseende.
Forsigtighedsforanstaltninger
•Før produktet anvendes, skal lægen omhyggeligt læse instruktionshæftet for at forstå produktets egenskaber og risikoen ved injektion. Lægen forventes at rådgive patienten og drøfte behandlingens mulige fordele og risici.
• Selve proceduren ved injektionsterapi medfører en risiko for infektion. Derfor bør almindelige forsigtighedsregler i forbindelse med injektionsterapi følges. Før injektionen bør lokal desinfektion udføres; under injektionen skal de sterile regler omkring kirurgisk behandling strengt overholdes.
•Ved patienter, der indtager medicin, som påvirker blodpladefunktionen, kan injektion medføre blå mærker eller blødning ved injektionsstedet.
•Gelens effekt og opholdstid påvirkes af defektens art, korrektionsgraden, injektionsdybden, lægens injektionsteknik og den enkelte persons fysiske konstitution. Brug af for stor mængde gel kan medføre risikoen for hævelse, og overdreven korrektion bør undgås.
•Inflammatorisk reaktion kan forårsages af laserbehandling, kemisk pelseeling eller andre behandlinger, der kan give hudirritation efter eller før injektion af gel. Hvis patienten har modtaget ovenstående behandling, skal det af en professionel læge vurderes, at huden er fuldt ud helbredt, før gelinjektion gives. Vedrørende ovenstående behandling skal der være bekræftet af en professionel læge 1 måned efter gelinjektion.
•Efter afsluttet injektion bør stedet for injektion ikke udsættes for intensiv varme (såsom solbadning) eller ekstreme koldemiljøer inden for 7 dage. Patienten bør undgå at indtage irriterende medicin eller fødevarer. Patienten bør ikke frit modtage hudplejebehandlinger såsom massasje og ansigtsemner; hvis sådanne behandlinger er nødvendige, skal patienten kontakte en professionel læge.
•Udskilingsperioden for gelens indhold af L-mælkesyreglykolcopolymer-mikrosfærer er relativt lang. Derfor er der stadig en risiko for underhudsknuder, rødme og kronisk granulomatøs sygdom (KGS) på injektionsstedet ved normale injektioner, ud over ved fejlagtige eller overdrevne injektioner.
•Gelinjektionen i kroppen medfører sjældent spredning eller forskydning af mikrosfærerne. Mikrosfærerne i gelen er vanskelige at fjerne direkte ved kirurgisk snit. Hvis lokal vævsødem, hærdning eller KGS opstår som følge af spredning eller forskydning af mikrosfærerne, kan topiske eller orale kortikosteroider samt lokal antiinflammatorisk behandling gives. Ved behov kan læsionerne fjernes kirurgisk sammen med mikrosfærerne.
•Bortset fra korrektion af nasolabiale folder er produktet ikke egnet til brug på andre områder, da sikkerhed og effekt ikke er dokumenteret.
•Bortset fra de dybe lag af dermis og det underliggende overfladiske og dybe lag er produktet ikke egnet til brug på andre lag, da sikkerhed og effekt ikke er dokumenteret.
•Sikkerhed og effekt af multiple injektioner af gelen er ikke dokumenteret.
•Sikkerhed og effekt af gelen hos gravide/ammande kvinder, mindreårige og ældre over 65 år er ikke dokumenteret. Det anbefales, at gelen anvendes på befolkningen i aldersgruppen 18–65 år.
•Sikkerhed og effekt af gelen i kombination med andre lægemidler og udstyr er ikke dokumenteret.
•Produktet skal efter brug eller efter udløbsdato kasseres som medicinsk affald.
FORVENTEDE UNGUNSTIGE REAKTIONER
En lokal, kortvarig, injektionsrelateret reaktion kan opstå efter gelinjektion. Mulige reaktioner omfatter hovedsagelig rødme, blåmærker, smerte, svømming og jøde på injektionsstedet. Disse reaktioner opstår typisk på injektionsdagen eller inden for 3–5 dage efter injektion, og forbedres normalt spontant efter omkring 1–4 uger. Normalt er kun enkle midler som iskompression tilstrækkelige. Hvis symptomerne er alvorlige, anbefales det at kontakte en læge for passende klinisk behandling ud fra alvoren af tilstanden.
SÆLDSOMME UNGUNSTIGE REAKTIONER
•Hudafhvidning ved injektionsstedet kan skyldes lidokain, som inducerer lokal kapillærkonstriktion.
•Nogle patienter kan udvikle hærdning eller små knuder ved injektionsstedet, som er relateret til injektionsteknikken og kan være enten akutte (inden for 1 måned efter injektion) eller forsinkede (flere måneder efter injektion). Små knuder forsvinder som udgangspunkt spontant. Ved alvorlige knuder kan der anvendes topisk kortikosteroidbehandling. Større knuder eller knuder, der er modstandsdygtige over for medicin, kan kræve kirurgisk fjernelse, hvilket bør drøftes med en læge.
•Nogle patienter kan opleve kortsigtede allergiske reaktioner, såsom lokaliseret erytem, svag hævelse og kløe. I alvorlige tilfælde kan det føre til dannelse af lokale papler eller quiner. Patienten kan kontakte en læge angående anvendelse af topiske eller orale kortikosteroider i kombination med fysisk behandling, såsom koldkompression. Hvis det er nødvendigt, kan et immunogenscreening udføres for at forebygge fremtidige allergiske reaktioner.
•Nogle patienter kan opleve en infektion ved implantatstedet på kort eller lang sigt. Rådfør dig med en læge omkring regulær antiinfektionsbehandling og overvej udledning ved kirurgisk snit, hvis nødvendigt.
•Nogle patienter kan opleve akutte eller kroniske alvorlige lokale inflammatoriske reaktioner, hudpigmentering osv. Rådfør dig med en læge omkring antiinflammatorisk og antihistaminisk behandling. Når den inflammatoriske aktive fase er afsluttet, kan man overveje at modtage andre relaterede behandlinger for at fjerne pigmentering.
•Ingen bivirkninger som granulom, epidermal nekrose og hives er blevet rapporteret i kliniske prøver af produktet; såfremt de forekommer, kan disse bivirkninger lindres ved anvendelse af topisk eller oral kortikosteroidbehandling i flere uger til måneder. Produktet bør ikke anvendes hos patienter, der har oplevet lignende bivirkninger tidligere.
•Vaskulær embolisme som bivirkning er ikke blevet rapporteret i produktets kliniske forsøg. Hvis gelen ved en fejl injiceres direkte i en blodåre, og patienten oplever nogen af følgende symptomer såsom synsforandringer, hvidnende hud i det påvirkede område eller unormal smerte, skal injektionen straks stoppes. Hvis patienten oplever ovenstående symptomer efter injektion, bør han/hun straks søge lægehjælp. Lokal injektion af hyaluronidase kan anvendes til at opløse natriumhyaluronatgelen. For fjernelse af mikrosfærer kan en helhedsorienteret terapeutisk tilgang anvendes, herunder fremmelse af vasodilatation, pleje af hudskader, ernæring og antiinflammatorisk behandling. Dette kan omfatte lokal varmepåske, brug af vasodilatorer såsom nitroglycerin, anvendelse af antibiotika lokalt eller systemisk antibiotikabehandling samt brug af topiske eller orale kortikosteroider som behandling.